Endüstri
Biyoteknolojik ve Biyobenzer İlaçların Dünyadaki ve Türkiye'deki Pazar Gelişimleri
20 Ocak 2021, Ça
Biyoteknolojik ilaçlar, dünya ilaç endüstrisinin en hızlı gelişen ve yeni yöntemler geliştirmeye açık olan yenilikçi alanıdır.
Biyoteknolojik ilaçlar, ulusal ve uluslararası kılavuzlarda biyolojik ilaç kapsamında değerlendirilen, rekombinant DNA teknolojisi kullanılarak canlı organizmalarda üretilen peptit/protein yapısında ürünler olup; küçük kimyasal moleküllerden üretim yöntemi, boyut, stabilite ve immünojenisite açısından farklılıklar gösterir. Biyofarmasötikler olarak da adlandırılan biyoteknolojik ilaçlar sitokinler, enzimler, hormonlar, kan veya plazma ürünleri, immünolojik ürünler, monoklonal antikorlar, gen ve hücre tedavisi ürünleri ve peptit terapötikler olarak gruplandırılabilir (1-3).
Biyoteknolojik ilaçlar, dünya ilaç endüstrisinin en hızlı gelişen ve yeni yöntemler geliştirmeye açık olan yenilikçi alanıdır. Ticari ürün olarak biyoteknolojik ilaç üretimi, ilk kez 1982 yılında insülin ile başlamış olup; şirketlerin ilaç portföyleri, yüksek teknolojili ürünlere doğru kaymaktadır. Günümüzde özellikle kanser, enfeksiyon, otoimmün hastalıklar, nörolojik hastalıklar, hematolojik hastalıklar, nadir hastalıklar gibi birçok hastalığın tedavisi için proteinler, enzimler, çeşitli hedef moleküllere yönelik geliştirilmiş monoklonal antikorlar, gen ve hücre tedavisi ürünleri gibi hastaların yaşam süresini ve kalitesini artıracak katkılar sağlayan çeşitli yenilikçi ürünler geliştirilmeye devam etmektedir.
Biyoteknolojik ilaçların patent sürelerinin dolmaya başlamasıyla birlikte ilaç endüstrisinde orijinal ilaçların biyobenzerleri de geliştirilmeye başlanmıştır. Biyobenzer ilaçlar, ruhsatlı biyolojik referans ilaçlara benzer olarak geliştirilen ürünlerdir. Bir ilacın biyobenzer olarak onaylanabilmesi için kapsamlı bir karşılaştırılabilirlik çalışmasına dayalı olarak, kalite, güvenlilik ve etkililik bakımından referans ilaca yüksek düzeyde benzerliğinin gösterilmesi gerekmektedir. Biyobenzerliğin gösterilmesi sürecinde yasal otoritelerin kabul ettiği ulusal ve uluslararası kılavuzlardaki gereklilikler sağlanmalıdır (4-8).
İlaçların etkili, güvenli ve kaliteli olduğunu garanti etmek için dünya çapında regülasyonların uyumlaştırılmasını amaçlayan Uluslararası Uyum Konseyi (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH) 1990 yılında ABD, Avrupa Birliği ve Japonya ilaç otoriteleri tarafından kurulmuştur ve şuan tüm dünyada ilaç regülasyonlarını yayımlamaktadır. TİTCK 27 Mayıs 2020 tarihi itibariyle aralarında ABD (FDA), Avrupa Birliği (EMA), Japonya (PMDA), İsviçre (Swissmedic), Kanada (Health Canada), Singapur (HSA), Güney Kore (MFDS), Çin (MNPA), Tayvan (TFDA), Brezilya (Anvisa) gibi ilaç otoritelerinin yer aldığı söz konusu Konseye tam üye olarak kabul edilmiştir. Ülkemizde onaylı tüm biyoteknolojik ve biyobenzer ilaçlar ICH standartlarını karşılamak zorundadır (9). Geliştirilen ürünlerde kalite, güvenlilik ve etkililiğin ICH standartlarında olması bir biyobenzerin dünya pazarındaki konumunu etkilemektedir.
Son yıllarda, dünya ilaç pazarında biyoteknolojik ilaçların payı giderek artmaktadır. Tüm dünyada toplam ilaç pazarının yaklaşık %70’ini konvansiyonel ilaçlar, %30’unu biyoteknolojik ilaçlar oluşturmaktadır. EvaluatePharma’nın dünyadaki 500 büyük ilaç firmasının verilerini kullanarak gerçekleştirdiği analize göre, 2019 yılında 910 milyar $’lık toplam reçeteli ve OTC ilaç satışlarının %29’unu biyoteknolojik ilaçlar oluşturmaktadır. Biyoteknolojik ilaçların pazar payının önümüzdeki beş yıl içinde %35’e çıkacağı tahmin edilmektedir (Şekil 1) (10, 11). 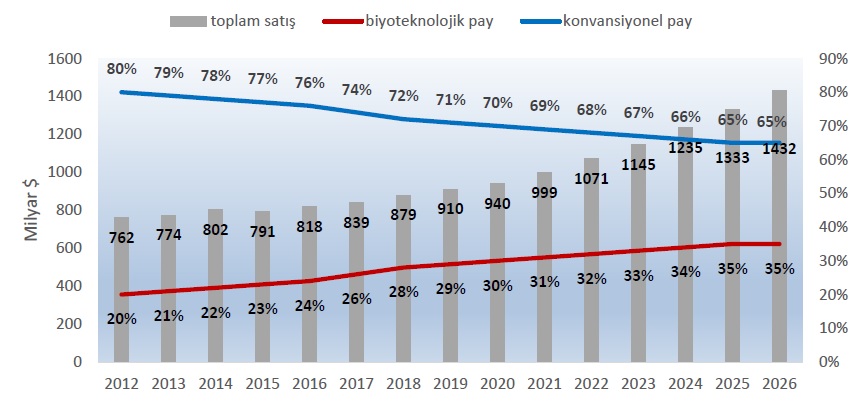
Şekil 1. Dünyada reçeteli ve OTC ilaç satışları (2012-2026) (11)
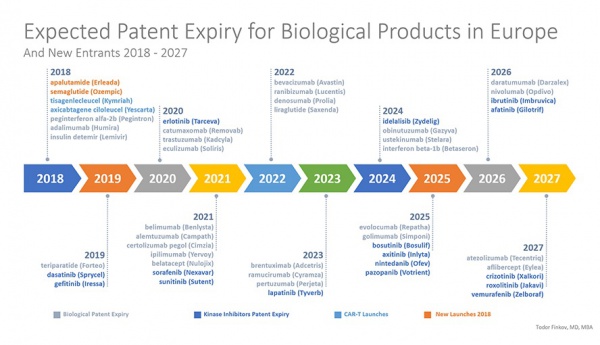
Pazardaki büyüme beklentisinin temel nedenlerinden birisi patent koruma süresi dolmak üzere olan çok sayıda referans biyoteknolojik ilacın biyobenzerlerinin pazara girecek olmasıdır (Şekil 2) (12).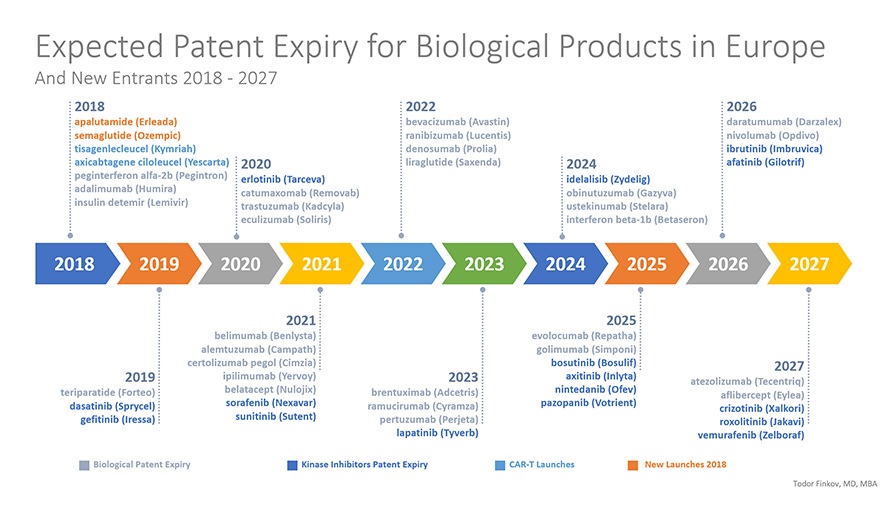
Şekil 2. Avrupa’da patent süresi dolacak biyolojik ürünler (2018-2027) (12)
IMS (Intercontinental Marketing Services) verilerine göre Türkiye; Çin, Brezilya, Meksika, Güney Kore, Hindistan ve Rusya ile birlikte gelişmekte olan yedi pazardan birisi olarak değerlendirilmektedir. Türkiye ilaç sektörünün 2018 yılında küresel satış hacmi 17. sırada bulunmakta, 2022 yılında ise 15. sıraya yükselmesi beklenmektedir (13).
Biyobenzer ilaç üretimi günümüzde Çin, Hindistan, Güney Kore gibi gelişmekte olan ülkelerde yoğunlaşmış olup, dünyadaki biyobenzer pazar dağılımı Kuzey Amerika, Latin Amerika, Avrupa, Asya Pasifik, Orta Doğu ve Afrika bölgelerini kapsamaktadır. Avrupa en büyük pazar hacmine sahiptir (Şekil 3) (14).
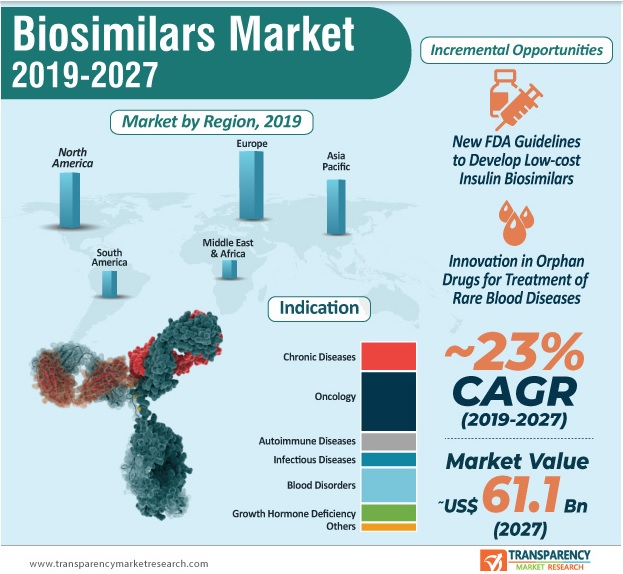
Şekil 3. Dünyadaki biyobenzer pazar dağılımı (14)
Dünyada biyobenzer pazarındaki ürün endikasyonları kronik hastalıklar, kanserler, otoimmün hastalıklar, enfeksiyon hastalıkları, kan hastalıkları, büyüme hormonu eksikliği ve diğerleri olarak sınıflandırılabilir. Bu endikasyonlarda kullanılan ve dünya pazarında yer alan terapötik biyobenzer ürünler ise rekombinant glikozillenmiş proteinler (monoklonal antikorlar, eritropoeitin ve diğerleri), rekombinant glikozillenmemiş proteinler (insülin, granülosit koloni stimüle edici faktör, rekombinant insan büyüme hormonu, interferonlar) ve rekombinant peptitlerdir (14).
Dünyada olduğu gibi Türkiye ilaç pazarında da biyoteknolojik ilaçlar stratejik önem taşıyan ürün grupları arasında yer almaktadır. Ülkemizde biyoteknolojik ilaç pazarı, satış değeri bazında sürekli bir büyüme göstermektedir. Biyoteknolojik ilaçlar, reçeteli ilaçların %17,2'sini oluşturarak 2019 yılında 7 milyar TL'ye ulaşmış ve 29,4 milyon kutu satış gerçekleşmiştir (Şekil 4). 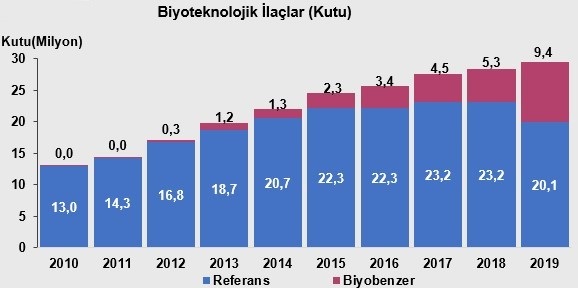
Şekil 4. Biyoteknolojik ve biyobenzer ilaçların Türkiye’deki pazar payı (kutu) (15)
2019 yılı itibari ile Türkiye’de referans biyoteknolojik ilaç pazarı değeri 6,4 milyar TL’ye, biyobenzer ilaç pazarı 624,4 milyon TL’ye ulaşmıştır (Şekil 5) (15). 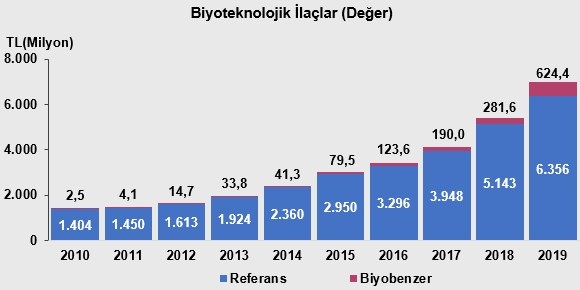
Şekil 5. Biyoteknolojik ve biyobenzer ilaçların Türkiye’deki pazar payı (değer) (15)
Sandoz tarafından geliştirilen Omnitrope (Somatotropin) adlı ürün EMA tarafından 2006 yılında onay alan dünyadaki ilk biyobenzer ilaçtır. FDA ilk kez 2015 yılında Sandoz tarafından geliştirilen Zarxio (Filgrastim) adlı ilaca biyobenzer onayı vererek biyobenzer ilaçlar için ilk onay süreçlerini başlatmıştır. Biyobenzer ilaçların kullanımı Amerika Birleşik Devletleri’nde daha yavaş olsa da, Avrupa Birliği ülkelerinde son yıllarda hızla artmıştır. Haziran 2020 itibariyle EMA tarafından onaylanan biyobenzer sayısı 66, FDA tarafından onaylanan biyobenzer sayısı 27’dir. Ülkemizde ise 2009 yılından itibaren biyobenzer ilaçlara kullanım onayı verilmektedir. Türkiye biyoteknolojik ilaç pazarı toplamda 139 marka altında 342 form ilaçtan oluşmaktadır. Söz konusu ilaçların 114 marka altında 256 formu referans biyoteknolojik ve 25 marka altında 86 formu biyobenzer ilaçlardan oluşmaktadır (16).
Türkiye’de absiksimab, adalimumab, enoksaparin sodyum, epoetin alfa, filgrastim, infliksimab, insülin glargine, rekombinant insan epidermal büyüme faktörü, rituksimab, somatropin, trastuzumab içeren biyobenzer ürünler ruhsatlandırılmış olup, bunlardan Türkiye’de üretimi olanlar; enoksaparin sodyum, epoetin alfa, filgrastim, infliksimab ve insülin glargine etkin maddelerini içermektedir. Ülkemizde onay alan biyobenzer ürünler Tablo 1’de görülmektedir (1).
|
Tablo 1. Türkiye’de onaylanmış biyobenzer ilaçlar (2009-2020) (1)
|
|||
|
Ürün |
Etkin Madde |
Üretim Yeri |
Ruhsat Tarihi |
|
Epobel |
Epoetin Zeta |
Almanya |
2009 |
|
Leucostim |
Filgastrim |
Güney Kore |
2009 |
|
Eporon |
Eritropoietin alfa |
Güney Kore |
2011 |
|
Omnitrope |
Somatropin |
Avusturya |
2011 |
|
Clotinab |
Absiksimab |
Güney Kore |
2012 |
|
Oksapar |
Enoksaparin sodyum |
Türkiye |
2012 |
|
Enox |
Enoksaparin sodyum |
Türkiye |
2013 |
|
Dropoetin |
Epoetin alfa |
Turkiye |
2013 |
|
Epoplus |
Epoetin alfa |
Küba |
2013 |
|
Remsima |
İnfliksimab |
Türkiye |
2014 |
|
Tevagrastim |
Filgrastim |
Meksika |
2015 |
|
Fraven |
Filgrastim |
Türkiye |
2016 |
|
Glarin |
İnsülin Glarjin |
Türkiye |
2016 |
|
Basaglar |
İnsülin Glarjin |
Fransa |
2016 |
|
Binocrit |
Epoetin alfa |
Almanya |
2016 |
|
Redditux |
Rituximab |
Hindistan |
2018 |
|
Canhera |
Trastuzumab |
Hindistan |
2018 |
|
Amgevita |
Adalimumab |
ABD |
2018 |
|
Zırabev |
Bevacizumab |
ABD |
2020 |
Biyoteknolojik ürünlerin patent sürelerinin dolmasıyla birlikte ilerleyen dönemlerde ülkemizde onay alan biyobenzer ürünlerin sayısının artması beklenmektedir. İlaç Endüstrisi İşverenler Sendikası’nın 2018 yılı raporunda, 2024 yılına kadar 2 adet referans biyoteknolojik, 39 adet biyobenzer, 1 adet biyoüstün ilacın ülkemizde üretiminin gerçekleştirilmesi için hazırlıkların yürütüldüğü bildirilmiştir. İthalatına bağımlı olduğumuz bu ürünlerin ülkemizde geliştirilmesi ve üretilmesi sadece hastaların bu ilaçlara erişimini kolaylaştırmayacak, aynı zamanda dış ticaret açığını azaltarak ülke ekonomisine de kayda değer bir katkı sağlayacaktır (17).
Tüm dünyada olduğu gibi ülkemizde de ilaç endüstrisinin geleceğine yön verecek olan alan farmasötik biyoteknolojidir. Ülkemizde farmasötik biyoteknoloji alanının gelişmesi sağlanarak bu alanda yetişmiş insan gücü artırılmalı, farmasötik biyoteknoloji alanındaki Ar-Ge faaliyetleri geliştirilerek, ilaç endüstrimize katkı sağlanmalıdır.
Dr. Öğr. Üye. Devrim DEMİR DORA
Akdeniz Üniversitesi Tıp Fakültesi
Tıbbi Farmakoloji Anabilim Dalı / Tıbbi Biyoteknoloji Anabilim Dalı Gen ve Hücre Tedavisi Anabilim Dalı Öğretim Üyesi
Akdeniz Üniversitesi Tıp Fakültesi Tıbbi Farmakoloji, Tıbbi Biyoteknoloji ve Gen ve Hücre Tedavisi Anabilim Dalları öğretim üyesidir. Hacettepe Üniversitesi Eczacılık Fakültesi’nden mezundur. Hacettepe Üniversitesi Sağlık Bilimleri Enstitüsü’nden 2004 yılında ‘Farmasötik Biyoteknoloji Doktora’ derecesini almıştır. T.C. Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu’nda Biyoteknolojik/Biyobenzer Ürünler için danışman öğretim üyesi olarak görev yapmaktadır. Biyoteknolojik/biyobenzer ilaçların üretimi ve ruhsatlandırılması, biyofarmasötiklerin formülasyonu, ileri tedavi tıbbi ürünleri, gen tedavisi tıbbi ürünleri için nükleik asit taşıyıcı sistemlerin geliştirilmesi araştırma alanlarıdır.
REFERANSLAR:
1. Biyoteknolojik İlaçlar: Biyolojik ve Biyobenzer İlaçların Üretimi, Kalitesi, Preklinik-Klinik Çalışmaları ve Güvenliliği, Alper İskit, Devrim Demir-Dora, İrfan Çiçin, Levent Kılıç, Cem Ar, Sedat Kiraz, Semra Sardaş, Saner Basım Hizmetleri San. Tic. Ltd. Şti., Araştırmacı İlaç Firmaları Derneği, 1. Basım, Eylül 2020, ISBN: 978-625-40034-4-8
2. Sorularla Biyoteknolojik ve Biyobenzer İlaçlar. Sadi Özdem, İrfan Çiçin, Devrim Demir Dora, Ceyda Korucu Nazlı, Ed: İrfan Çiçin, Güneş Tıp Kitapevleri 2017. ISBN: 978-975-277-697-5
3. Demir-Dora D. Biyofarmasötik Ürünlerin Geliştirilmesinde Biyobelirteçler. Turkiye Klinikleri J Pharmacol- Special Topics 2017; 5(2):75-83.
4. T.C. Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu, Biyobenzer İlaçlara İlişkin Kılavuz, 07.08 2008.
5. T.C. Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu, Biyobenzer İlaçlar Hakkında Kılavuz Taslağı. 30.05.2017, https://www.titck.gov.tr/mevzuat/biyobenzer-tibbi-urunler-hakkinda-kilavuzu- taslagi-27122018173016 (Erişim: 20.11.2019)
6. European Medicines Agency (EMA), Committee for Medicinal Products for Human Use (CHMP). Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (EMA/CHMP/BWP/247713/2012 Rev1), 22 May 2014.
7. European Medicines Agency (EMA), Committee for Medicinal Products for Human Use (CHMP). Guideline on similar biological medicinal products (CHMP/437/04 Rev 1), 23 October 2014.
8. U.S. Department of Health and Human Services Food and Drug Administration, Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER). Scientific Considerations in Demonstrating Biosimilarity to a Reference Product, Guidance for Industry. April 2015.
9. www.ıch.org (Erişim: 15.01.2020)
10. EvaluatePharma World Preview 2020, Outlook to 2026
11. T.C. Sanayi ve Teknoloji Bakanlığı, Sanayi ve Verimlilik Genel Müdürlüğü, Sektörel Raporlar ve Analizler Serisi, İlaç Sektörü Raporu, 2020
12. http://www.wednesdayupdate.com/expected-patent-expiry-of-biological-products-in-europe-2018-2027/ (Erişim:15.01.2020)
13. T.C. Ticaret Bakanlığı, İhracat Genel Müdürlüğü, Sektör Raporları, İlaç ve Eczacılık Ürünleri Sektörü Raporu, 2020
14. https://www.transparencymarketresearch.com/biosimilars-market.html (Erişim:15.01.2020)
15. http://www.ieis.org.tr/ieis/tr/indicators/33/turkiye-ilac-pazari (Erişim:15.01.2020)
16. İEİS, Türkiye İlaç Pazarı, Ocak-Eylül, 2020
17. İEİS, Türkiye İlaç Sektörü Raporu, 2018



