Dosya

AŞI GELİŞTİRME SÜRECİNDE TİTCK
15 Aralık 2020, Sa
Tüm dünyaya paralel olarak ülkemizde de görülen COVID-19 pandemisinin etkilerinin sona erdirilebilmesi için dünyada ve ülkemizde aşı çalışmaları devam etmekte.
Bir aşının gelişim aşamaları; virüsün ve sebep olduğu enfeksiyonun analizi, aşı adayının tasarımı, aşı adayının laboratuvar ortamı ve deney hayvanlarında etkililik ve güvenliliğinin test edilmesi ve insanlar üzerinde yapılan klinik araştırmalardan oluşur. Aşı adaylarının insana uygulama aşamasına, yani klinik araştırma dönemine geçebilmeleri için, gerek uluslararası kılavuzlara gerekse ulusal mevzuatımıza uygun şekilde klinik dışı çalışmalarının tamamlanmış olması gerekmektedir. Ancak, klinik dışı çalışmalarda etkili ve güvenli olduğu gösterilen aşı adayları klinik araştırma safhasına geçebilir. Aynı zamanda, aşı adaylarının İyi İmalat Uygulamaları (Good Manufacturing Practice - GMP) ilkelerine uygun olarak üretilmiş olması ve tüm kalite gerekliliklerini sağlıyor olması gerekmektedir.
Tüm bu araştırma ve geliştirme aşamalarında doğru ve geçerli sonuçların ortaya konması; klinik dışı çalışmalar ile klinik araştırmaların bilimsel kurallara uygun olarak tasarlanması, değerlendirilmesi, yürütülmesi ve yorumlanması; üretimin tanımlı kalite standartlarında ve denetlenmiş tesislerde yapılması hayati önem taşımaktadır.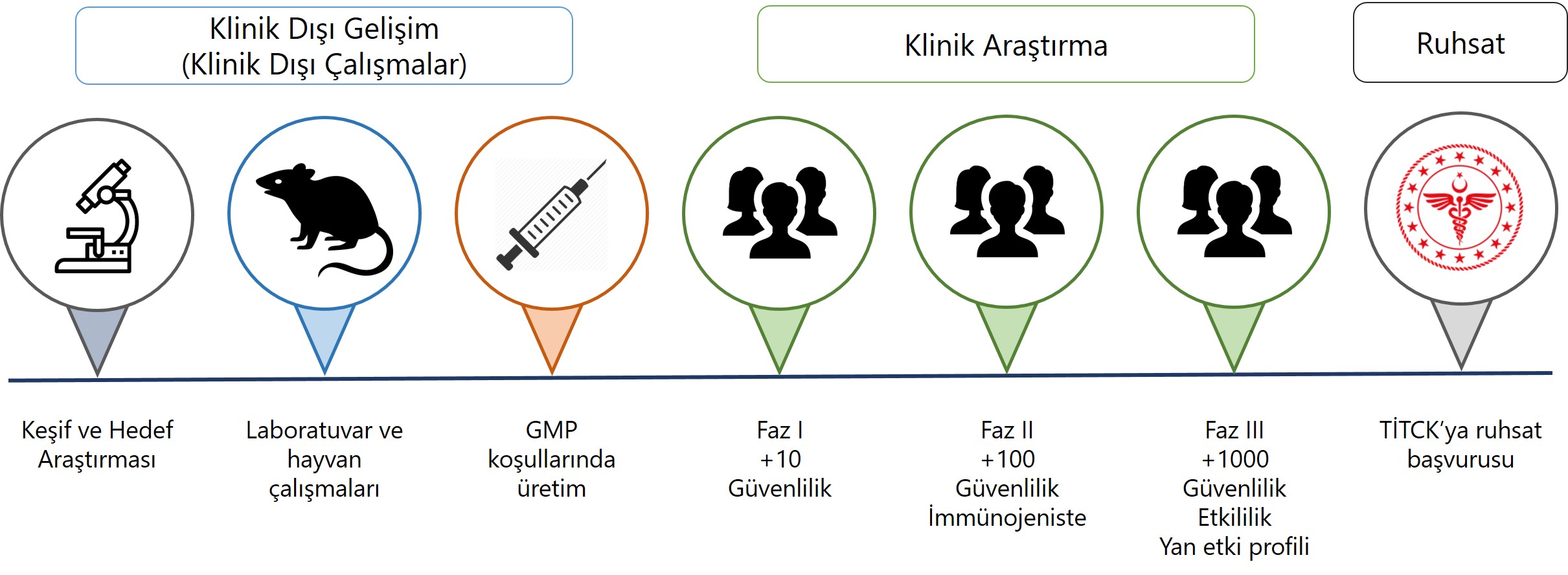
10/7/2018 tarihli ve 4 sayılı Bakanlıklara Bağlı, İlgili, İlişkili Kurum ve Kuruluşlar ile Diğer Kurum ve Kuruluşların Teşkilatı Hakkında Cumhurbaşkanlığı Kararnamesi’nin 508’inci maddesi uyarınca; aşı da dâhil olmak üzere görev alanına giren ilaç, tıbbî cihaz ve ürünlere ilişkin klinik araştırmalarla ilgili düzenlemeleri yapmak, izin vermek ve denetlemek; bu ürünlerin ruhsatlandırılması, üretimi, depolanması, satışı, ithalatı, ihracatı, piyasaya arzı, dağıtımı, hizmete sunulması, toplatılması ve kullanımları ile ilgili kural ve standartları belirlemek, bu faaliyetleri yürütecek kamu ve özel hukuk tüzel kişileri ile gerçek kişilere izin vermek, ruhsatlandırmak, denetlemek ve gerektiğinde yaptırım uygulamak; bu ürünlerin laboratuvar analizlerini yapmak veya yaptırmak Türkiye İlaç ve Tıbbi Cihaz Kurumu’nun (TİTCK) görevidir. Özetle; aşı adaylarının klinik araştırmaları, üretim tesislerinin denetimleri ve ruhsatlandırılması, ürünlerin ruhsatlandırılması ve piyasa arzı konusunda ülkemizde yetkili sağlık otoritesi TİTCK’dır.
COVID-19 pandemisi sürecinde aşı geliştirilmesi konusunun önemi ve aciliyeti aşikârdır. COVID-19 aşısı geliştirilmesi sürecinde, gerek DSÖ gerekse Avrupa İlaç Ajansı ve Amerika Gıda ve İlaç Ajansı’nın da içinde yer aldığı otoriteler, “Acil Halk Sağlığı Durumu” nedeniyle çeşitli istisnalar sağlamaktadırlar. TİTCK, tüm bilimsel gelişmeleri yakından takip etmekte, uluslararası uygulamalara paralel olarak aşı geliştiren gruplara yol gösterici faaliyetler yürütmektedir. Kurum, pro-aktif davranarak, COVID-19 aşı çalışması yürüten ve yürütecek olan araştırma gruplarına yol göstermesi için oldukça detaylı bilgiler içeren “Viral Aşı Adaylarının Klinik Araştırmalara Geçişi İçin Gereklilikler Tablosu” hazırlamış ve tüm paydaşlara iletmiştir. Aynı zamanda, “Beşeri Aşıların Klinik Dışı Değerlendirilmesine İlişkin Kılavuz”u yayımlayarak aşı geliştirme gruplarına klinik araştırma aşamasına geçiş öncesi tamamlanması gereken çalışmalar yönünden rehberlik sağlamıştır. Kurum, hâlihazırda yürütülen ve yürütecek olan aşı çalışmaları için yönlendirme faaliyetlerine etkili şekilde devam etmektedir.
COVID-19 aşı adayları için klinik araştırma dönemine geçmeden önce ilgili mevzuat ve kılavuzlar doğrultusunda aşağıda belirtilen çalışmalar yürütülmeli ve gerekli veriler Kurum’a sunulmalıdır:
1. Kalite Dosyası
2. Preklinik Çalışmalar
Toksisite Çalışmaları
Tek Doz Toksisite Çalışmaları *
Tekrarlı Doz Toksisite Çalışmaları
Üreme ve Gelişimsel Toksisite Çalışmaları *
Genotoksisite ve Karsinojenisite Çalışmaları *
Farmakodinamik Çalışmalar
İmmunojenisite Çalışmaları (Primer)
Güvenlilik Farmakolojisi (Sekonder) *
Farmakokinetik Çalışmalar *
Lokal Tolerans
Ek Çalışmalar *
* Aşı adayı formülasyonunun ve türünün gerekli kılması veya daha önce yapılmış klinik dışı çalışmalardan/klinik araştırmalardan ya da aşı adayı gelişim sürecinde yapılacak klinik dışı çalışmalardan/klinik araştırmalardan elde edilen verilerin gerekli kılması durumunda yapılmalıdır.
Ülkemizde klinik araştırmalar 3359 sayılı Sağlık Hizmetleri Temel Kanunun ek onuncu maddesi ve Kanun maddesine istinaden yayımlanmış yönetmelik, genelge ve kılavuzlar ile düzenlenmektedir. Bu düzenlemelere göre bir aşı klinik araştırmasının yapılabilmesi için Kanun maddesi ve alt düzenlemelerde belirtilen temel gerekliliklerin sağlanması, ilgili etik kurulun bu araştırmayı etik ve bilimsel açıdan uygun görmesi ve TİTCK’nın ilgili araştırmaya izin vermesi gerekmektedir. Kurum, klinik dışı çalışmaların ve varsa daha önce yapılmış klinik araştırmaların sonuçlarını uluslararası standartlar, etik ve bilimsel gereklilikler ile mevzuat yönünden değerlendirir, uygun olan araştırmaların yürütülmesine izin verir. Bu araştırmalar ancak TİTCK’nın iznine müteakiben başlayabilir.
Klinik araştırmalara katılacak gönüllülerin, araştırmanın mahiyet ve sonuçları hakkında yeterli bilgilendirmeye dayalı olarak klinik araştırmaya katılma konusunda yazılı rızasının olması ve bu rızanın da herhangi bir menfaat teminine bağlı bulunmaması gerekmektedir. Gönüllüler, gerekçeli veya gerekçesiz olarak, kendi rızasıyla, istediği zaman araştırmalardan ayrılabilir ve bundan dolayı sonraki tıbbi takibi ve tedavisi sırasında mevcut haklarından herhangi bir kayba uğratılamazlar.
Gönüllülerin klinik araştırmadan doğabilecek zararlara karşı güvence altına alınması amacıyla da Faz I, Faz II ve Faz III dönem araştırmalarda sigorta yapılması zorunludur.
Araştırmalar; üzerinde araştırma yapılacak kişilerin emniyetini sağlamaya ve araştırmanın sağlıklı bir şekilde yürütülebilmesine, takibine ve gereğinde acil müdahale yapılabilmesine elverişli ve araştırmanın vasfına uygun personel, teçhizat ve laboratuvar imkânlarına sahip olan üniversite hastaneleri, üniversitelere bağlı onaylanmış araştırma-geliştirme merkezleri, Sağlık Bakanlığı eğitim ve araştırma hastanelerinde ve gerekli durumlarda bu merkezlerin koordinatörlüğünde aynı şartlara haiz diğer sağlık kurum/kuruluşlarında yapılabilir. Bu merkezlerde yürütülecek araştırmalar uzman hekim olan sorumlu araştırmacının başkanlığında uygun bir ekip tarafından yürütülür.
Bununla birlikte, araştırma ürünlerinin insanlar üzerinde ilk kez araştırıldığı aşama olan Faz I araştırmaları sadece Kurum’un denetlediği ve onayladığı merkezlerde gerçekleştirilebilir. Bu durum, gönüllülerin güvenliğinin en üst seviyede sağlanarak araştırmaların yürütülebilmesine imkân sağlamaktadır. Mevcut durumda, Kurum tarafından Faz I merkezi olarak onaylanmış 8 merkez bulunmaktadır.
Yapılan klinik araştırmalardan elde edilen sonuçlar doğrultusunda insanlarda etkili ve güvenli olduğu gösterilen aşı adayları için Kurum’a ruhsatlandırma başvurusu yapılır. Ruhsat, bir beşeri tıbbi ürünün belirli bir formül ile belirli bir farmasötik şekil ve yitilikte, kabul edilen ürün bilgilerine uygun olarak üretilip piyasaya sunulabileceğini gösteren, Kurum tarafından düzenlenen belgedir. 26/5/1928 tarihli Resmi Gazete’de yayımlanan 1262 sayılı İspençiyari ve Tıbbi Müstahzarlar Kanunu ile ülkemiz piyasasına sunulacak beşeri tıbbi ürünler için ruhsat düzenlenmeye başlanmıştır. Ülkemizde piyasaya sunulacak her beşeri tıbbi ürünün Kurumdan ruhsat alması gerekmektedir. Kurum beşeri tıbbi ürünleri kalite, etkililik ve güvenlilik verileri doğrultusunda bilimsel açıdan ve mevzuat yönünden değerlendirir ve ruhsatlandırır.
Aşı üretiminin yapılacağı tesislerin İyi İmalat Uygulamaları ilkelerine uyum açısından değerlendirilmesi ve gerekli izinlerin verilmesi de TİTCK tarafından yapılmaktadır.
TİTCK, COVID-19 pandemisinin etkilerinin sona erdirilmesi ve COVID-19 aşısının ülkemiz insanlarına ulaştırılması yönündeki tüm çalışmaları yakından takip etmekte, bu konuda yönlendirme faaliyetlerini sürdürmekle birlikte etkili ve güvenli aşıların kullanıma sunulması yönünden düzenleyici ve denetleyici fonksiyonlarını en etkin şekilde icra etmektedir.



